日 연구진, 내구성과 단백질 합성 효율 높여
신종 코로나바이러스 감염증(코로나19)에서 인류를 구한 메신저리보핵산(mRNA) 백신 기술이 암과 유전질환, 자가면역질환 치료까지 영역을 넓히고 있다. 하지만 병든 세포를 제대로 찾지 못하고 치료 효과가 오래 가지 않는 문제가 있었다. 일본 연구진이 mRNA의 형태를 바꿔 이런 문제를 해결할 단서를 찾았다.
일본 나고야대 연구진은 인체에 주입한 mRNA 치료제가 암세포에서만 치료용 단백질 합성을 하는 방법을 찾았다고 19일 국제 학술지 ‘네이처 바이오테크놀로지(Nature Biotechnology)’에 밝혔다.
생명체는 특정 단백질에 대한 유전정보를 mRNA로 옮겨 원하는 단백질을 만든다. 결국 인체에 투여한 mRNA가 단백질을 많이 만들수록 치료 효과가 높아진다. 단백질 합성 효율이 낮으면 치료 효과가 떨어져 mRNA 치료제를 자주 투여해야 한다.
연구진은 기존 mRNA 치료법에 쓰이는 선형 mRNA보다 안정성이 뛰어난 원형 mRNA를 활용했다. 선형 mRNA는 몸 안에서 효소에 쉽게 분해되지만, 원형 mRNA는 말단 구조가 없어 상대적으로 안정성이 높다. 그만큼 장기간 단백질 합성이 가능하다. 한 번 투여로도 오랜 기간 치료 효과를 유지할 수 있다는 말이다.
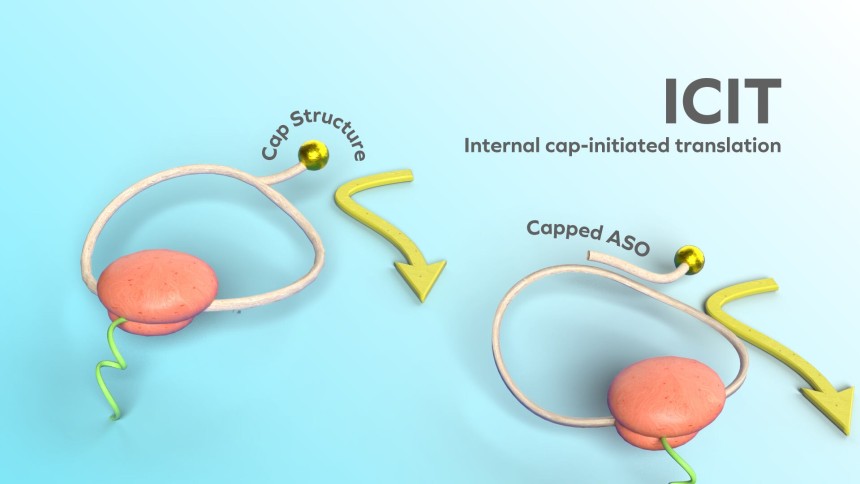
문제는 원형 mRNA는 선형보다 단백질을 합성하는 효율이 낮다는 점이다. 연구진은 이 한계를 해결하기 위해 원형 mRNA 자체에 캡(CAP) 구조를 도입하는 방식을 개발했다. 캡은 단백질 생산을 돕고, mRNA가 파괴되지 않도록 막아준다. 연구진은 선형에만 있던 캡 구조를 원형 mRNA에 삽입해 단백질 합성 효율을 높였다. 캡을 가진 원형 mRNA는 기존 방식보다 장기간 유지되면서도 최대 200배 많은 단백질을 합성할 수 있었다고 연구진은 밝혔다.
연구진은 인체 간암 세포에 새로운 원형 mRNA를 실험했다. 해당 mRNA는 간암 세포에서만 많이 만들어지는 특정 RNA를 감지하면 단백질 합성을 지시하도록 설계했다. 실험 결과, 정상 세포에서는 mRNA가 작동하지 않아 아무런 변화가 없었지만, 간암 세포에서만 단백질 합성량이 50배 이상 증가했다. 정상 세포에는 영향을 주지 않으면서 암세포에서만 선택적으로 치료 효과를 발휘할 수 있다는 뜻이다.
연구진은 이번 기술을 활용하면 병에 걸린 세포에서만 치료 단백질이 합성되도록 할 수 있어, 부작용을 최소화하면서 효과적으로 질병을 치료할 수 있다고 밝혔다.
아베 히로시(Abe Hiroshi) 나고야대 교수는 “현재 사용되는 mRNA 약물은 불안정해 반복적인 주사가 필요하지만, 이번에 개발한 기술은 이러한 문제를 해결할 수 있다”며 “이 기술을 활용하면 암세포에서만 독성 단백질을 생성하도록 mRNA 치료제를 설계해 암세포의 자멸을 유도할 수 있다”고 했다.
참고 자료
Nature Biotechnology(2025), DOI: https://doi.org/10.1038/s41587-025-02561-8
일본 연구진이 암세포와 같은 질병 세포에서만 선택적으로 작용하는 새로운 mRNA 기술을 개발했다./타다 미즈키
신종 코로나바이러스 감염증(코로나19)에서 인류를 구한 메신저리보핵산(mRNA) 백신 기술이 암과 유전질환, 자가면역질환 치료까지 영역을 넓히고 있다. 하지만 병든 세포를 제대로 찾지 못하고 치료 효과가 오래 가지 않는 문제가 있었다. 일본 연구진이 mRNA의 형태를 바꿔 이런 문제를 해결할 단서를 찾았다.
일본 나고야대 연구진은 인체에 주입한 mRNA 치료제가 암세포에서만 치료용 단백질 합성을 하는 방법을 찾았다고 19일 국제 학술지 ‘네이처 바이오테크놀로지(Nature Biotechnology)’에 밝혔다.
생명체는 특정 단백질에 대한 유전정보를 mRNA로 옮겨 원하는 단백질을 만든다. 결국 인체에 투여한 mRNA가 단백질을 많이 만들수록 치료 효과가 높아진다. 단백질 합성 효율이 낮으면 치료 효과가 떨어져 mRNA 치료제를 자주 투여해야 한다.
연구진은 기존 mRNA 치료법에 쓰이는 선형 mRNA보다 안정성이 뛰어난 원형 mRNA를 활용했다. 선형 mRNA는 몸 안에서 효소에 쉽게 분해되지만, 원형 mRNA는 말단 구조가 없어 상대적으로 안정성이 높다. 그만큼 장기간 단백질 합성이 가능하다. 한 번 투여로도 오랜 기간 치료 효과를 유지할 수 있다는 말이다.
문제는 원형 mRNA는 선형보다 단백질을 합성하는 효율이 낮다는 점이다. 연구진은 이 한계를 해결하기 위해 원형 mRNA 자체에 캡(CAP) 구조를 도입하는 방식을 개발했다. 캡은 단백질 생산을 돕고, mRNA가 파괴되지 않도록 막아준다. 연구진은 선형에만 있던 캡 구조를 원형 mRNA에 삽입해 단백질 합성 효율을 높였다. 캡을 가진 원형 mRNA는 기존 방식보다 장기간 유지되면서도 최대 200배 많은 단백질을 합성할 수 있었다고 연구진은 밝혔다.
연구진은 인체 간암 세포에 새로운 원형 mRNA를 실험했다. 해당 mRNA는 간암 세포에서만 많이 만들어지는 특정 RNA를 감지하면 단백질 합성을 지시하도록 설계했다. 실험 결과, 정상 세포에서는 mRNA가 작동하지 않아 아무런 변화가 없었지만, 간암 세포에서만 단백질 합성량이 50배 이상 증가했다. 정상 세포에는 영향을 주지 않으면서 암세포에서만 선택적으로 치료 효과를 발휘할 수 있다는 뜻이다.
연구진은 이번 기술을 활용하면 병에 걸린 세포에서만 치료 단백질이 합성되도록 할 수 있어, 부작용을 최소화하면서 효과적으로 질병을 치료할 수 있다고 밝혔다.
아베 히로시(Abe Hiroshi) 나고야대 교수는 “현재 사용되는 mRNA 약물은 불안정해 반복적인 주사가 필요하지만, 이번에 개발한 기술은 이러한 문제를 해결할 수 있다”며 “이 기술을 활용하면 암세포에서만 독성 단백질을 생성하도록 mRNA 치료제를 설계해 암세포의 자멸을 유도할 수 있다”고 했다.
참고 자료
Nature Biotechnology(2025), DOI: https://doi.org/10.1038/s41587-025-02561-8